Será então o NÚCLEO fundamental? (parte 1)
Devido à sua aparência sólida e densa, os cientistas pensaram inicialmente que o núcleo era uma partícula fundamental com carga positiva. No entanto, mais tarde, descobriram que este na realidade não era indivisível...
No início do século XIX, Frederick Soddy estava confuso. O decaimento radioactivo transformava os átomos de um elemento em átomos de outro elemento. Mas como?
Os elementos encontravam-se listados, por volta de 1800, de acordo com o seu número atómico. Este encontrava-se definido de acordo com uma escala na qual o átomo de carbono pesava exactamente 12 unidades. Assim, a massa atómica do hidrogénio seria de aproximadamente 1, a do hélio aproximadamente 4 e assim sucessivamente. Depois da criação da Tabela Periódica dos Elementos, por Mendeleyev em 1869, conforme já tinhamos visto no post anterior, os elementos começaram a ser classificados de acordo com as suas propriedades químicas mais, ou menos, semelhantes.
Soddy, regressando agora ao tema do decaimento radioactivo, pediu ao seu colega, Alexander Fleck, que analisasse os produtos do decaimento do urânio, 92U, e do tório, 90Th, dois metais de transição da família dos actinídeos. Os resultados da análise foram comparados com a Tabela Periódica (TP). Soddy reparou que sempre que um elemento emitia uma partícula a (um núcleo de hélio, 2He), produzia um elemento duas casas para a esquerda, ou seja, decaía para um elemento de número atómico inferior. Quando um elemento emitia electrões, produzia um elemento uma casa para a direita, portanto, decaía para um elemento de número atómico superior. Assim, por exemplo, o polónio-218 (ou seja, polónio com massa atómica 218) emitiria uma partícula a produzindo chumbo-214. Este último emitiria um electrão dando origem a bismuto-214. Por fim o bismuto-214 emitiria por sua vez um electrão, produzindo polónio-214.
Parece confuso? Imaginem a confusão que foi para os cientistas que o observaram pela primeira vez! Levou muitos anos até os radioquímicos descortinarem o que se passava nos meandros dos decaimentos radioactivos...
Quando um elemento radioactivo emitia uma partícula a e dois electrões, acabava por ficar no mesmo local da TP, mas estava mais leve - quatro unidades de massa atómica mais leve. Um elemento podia ter até 4 massas atómicas diferentes. Soddy chamou isótopos a estas formas distintas do mesmo elemento. A palavra isótopo significa "o mesmo lugar", uma vez que estes elementos ocupavam o mesmo local na TP: assim, todos os isótopos têm o mesmo número atómico.
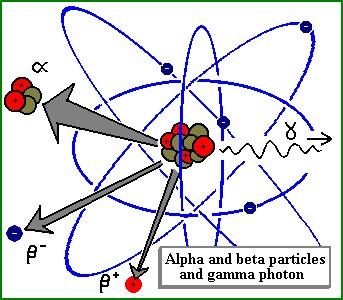
O decaimento a, que tem sido aqui falado, não é o único tipo de decaimento que ocorre na natureza. De facto, existem três tipos de decaimento: a, b e g. Cada um deles se refere ao tipo de partícula emitida quando ocorre o decaimento do átomo. No caso do decaimento b a partícula é um electrão (e-) ou um positrão (e+): o caso que se tem estado a considerar é o do electrão, razão pela qual o elemento anda uma casa para a direita na TP, dado que o electrão é libertado para que um neutrão seja convertido num protão - contudo, na altura ainda não se sabia da existência do neutrão, cuja descoberta discutiremos mais à frente. Por fim, o decaimento g é a forma mais comum de desexcitação dum átomo, já que a partícula g emitida é, neste caso, um fotão.
Voltemos, no entanto, à questão do número atómico.
O que nos diz o número atómico sobre um átomo?
O físico holandês Antonius van den Broek pensava que o número atómico correspondia ao número de unidades de carga eléctrica contidas no núcleo. Convém referir que uma unidade de carga corresponde à carga eléctrica de um ião de hidrogénio. Um electrão tem carga -1. Uma partícula a (núcleo de He) tem carga +2.
Assim, de acordo com van den Broek, o núcleo de hidrogénio teria carga +1. O núcleo de ouro, por exemplo, o septuagésimo nono elemento da TP, teria carga +79. Soddy concordou com a previsão de van den Broek, pois esta explicava a sequência de decaimentos radioactivos observada. Quando, por exemplo, um átomo de polónio (elemento n.º 84) emitisse uma partícula a, perderia duas unidades de carga nuclear. O que ficava era um átomo de chumbo (elemento n.º 82). Quando o átomo de chumbo emitisse um electrão, ganhava uma unidade de carga e tornava-se em bismuto (elemento n.º 83). Se emitisse mais um electrão, o bismuto ganharia mais uma unidade de carga e tornar-se-ia polónio.
A conclusão final sobre a hipótese de van den Broek chegou com as experiências de Henry Mosely. Este cientista usou raios catódicos para desviar os electrões atómicos das suas órbitas. Quando os electrões regressavam à órbita que haviam deixado ocorria emissão de radiação electromagnética. Segundo a teoria atómica de Bohr, o salto de um electrão para a órbita mais interna de um átomo pesado provocava a emissão de raios-X (RX). A partir do comprimento de onda (c.o.) dos RX emitidos, Mosely podia calcular a carga do núcleo...
Se bem o pensou, melhor o fez. Mediu o c.o. dos RX de 38 elementos, desde o alumínio (massa atómica 27) até ao ouro (massa atómica 197) - é preciso não esquecer que nem todos os elementos eram ainda conhecidos na época em que Mosely realizou estas medições. Porém, as conclusões foram determinantes: conforme percorria a TP, elemento a elemento, descobriu que a carga do núcleo aumentava de 1 unidade. Indubitável, meu caro Mosely: estava provado que a carga nuclear é igual ao número atómico do elemento.
(to be continued...)

0 Comments:
Enviar um comentário
<< Home