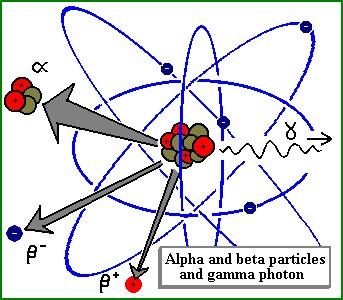
Será então o NÚCLEO fundamental? (parte 2)
Tinha-se, pois, chegado à conclusão de que a carga nuclear de um elemento era igual ao seu número atómico. Assim, o hidrogénio teria carga +1, o hélio +2, o lítio +3 e por aí adiante. No entanto, a composição do núcleo atómico não estava ainda totalmente elucidada.
Uma outra pista sobre este aspecto surgiu de experiências de dispersão a. Ernest Marsden questionava-se sobre o que aconteceria se bombardeasse núcleos leves com raios a (ver artigo). Quando, em 1914, aceitou um cargo como professor na Nova Zelândia, deixando assim incompletas as suas investigações (devido à falta do equipamento necessário, indisponível nos laboratórios da sua nova instituição) Rutherford, com quem trabalhara, decidiu prossegui-las ele mesmo. Contudo, a História interveio e fez com que Rutherford só continuasse as experiências quatro anos mais tarde, após o fim da 1ª Guerra Mundial (1918).
Quando fez incidir partículas a sobre nitrogénio gasoso (N2), notou algo estranho: algumas das cintilações que surgiam no seu detector não pareciam provir nem das partículas a nem dos átomos de nitrogénio; pareciam cintilações típicas de núcleos de hidrogénio. Começou por pensar que estes núcleos provinham da fonte de rádio (88Ra) que utilizava como emissor de partículas a. Só posteriormente chegou à conclusão de que afinal provinham dos próprios átomos de nitrogénio! Sucedia que alguns dos átomos de nitrogénio se estavam a desintegrar quando eram atingidos pelas partículas a: Rutherford estava a transformar átomos de nitrogénio (7N) em átomos de oxigénio (8O). A sua experiência convenceu-o de que os átomos de nitrogénio continham núcleos de hidrogénio no seu interior, o que significava que os núcleos de hidrogénio eram partículas fundamentais. Rutherford deu-lhes o nome de protões, do grego "protos" que significa "primeiro".
Uma outra pista sobre este aspecto surgiu de experiências de dispersão a. Ernest Marsden questionava-se sobre o que aconteceria se bombardeasse núcleos leves com raios a (ver artigo). Quando, em 1914, aceitou um cargo como professor na Nova Zelândia, deixando assim incompletas as suas investigações (devido à falta do equipamento necessário, indisponível nos laboratórios da sua nova instituição) Rutherford, com quem trabalhara, decidiu prossegui-las ele mesmo. Contudo, a História interveio e fez com que Rutherford só continuasse as experiências quatro anos mais tarde, após o fim da 1ª Guerra Mundial (1918).
Quando fez incidir partículas a sobre nitrogénio gasoso (N2), notou algo estranho: algumas das cintilações que surgiam no seu detector não pareciam provir nem das partículas a nem dos átomos de nitrogénio; pareciam cintilações típicas de núcleos de hidrogénio. Começou por pensar que estes núcleos provinham da fonte de rádio (88Ra) que utilizava como emissor de partículas a. Só posteriormente chegou à conclusão de que afinal provinham dos próprios átomos de nitrogénio! Sucedia que alguns dos átomos de nitrogénio se estavam a desintegrar quando eram atingidos pelas partículas a: Rutherford estava a transformar átomos de nitrogénio (7N) em átomos de oxigénio (8O). A sua experiência convenceu-o de que os átomos de nitrogénio continham núcleos de hidrogénio no seu interior, o que significava que os núcleos de hidrogénio eram partículas fundamentais. Rutherford deu-lhes o nome de protões, do grego "protos" que significa "primeiro".
Rutherford concluiu assim que todos os núcleos deveriam ser constituídos por protões e electrões. As partículas a, ou núcleos de hélio (2He), seriam constituídos por 4 protões e 2 electrões interligados por forças eléctricas. O núcleo de lítio (3Li) teria 7 protões e 4 electrões. E assim sucessivamente...
Se 2 electrões se podiam associar a 4 protões, seria possível associar 1 electrão a 1 protão? Rutherford pensava que sim. A hipotética partícula, a que ele chamou de neutrão, teria propriedades pouco comuns, como o facto de ser capaz de atravessar a matéria e penetrar no núcleo.
Dois dos seus alunos realizaram experiências com o intuito de localizar as tais duplas electrão + protão, ou seja, os neutrões... mas não encontraram qualquer manifestação da sua presença. Rutherford fizera a sua previsão da existência do neutrão em 1920, mas só 12 anos mais tarde viria a ser descoberto, pelo seu assistente James Chadwick.
Em 1930 os físicos alemães W. Bothe e H. Becker descobriram algo estranho. Quando bombardeavam berílio (n.º atómico 4) com raios a, este elemento emitia uma radiação neutra capaz de penetrar 200 milímetros de chumbo, ao passo que um protão conseguia penetrar menos de 1 milímetro! Enquanto Bothe e Becker, juntamente com a filha de Marie Curie, Irene Joliot-Curie e o seu marido, Frederic, diziam que a radiação do berílio observada eram raios gama, Chadwick pensava ter finalmente descoberto os neutrões (depois de duas tentativas falhadas em 1923 e 1928). Para testar a sua hipótese, Chadwick montou uma experiência na qual colocou um pedaço de berílio numa câmara de vácuo, juntamente com algum polónio. O polónio emitia raios a, que atingiam o berílio. Quando atingido, o berílio emitia por sua vez os misteriosos raios neutros. No percurso desses raios, Chadwick colocou um alvo. Quando os raios atingiam o alvo provocavam a libertação de átomos para o exterior. Estes átomos, carregados electricamente (devido à colisão) viajavam até um detector, o qual consistia numa câmara cheia de gás. Sempre que uma partícula carregada atravessava esta câmara, as partículas de gás ficavam ionizadas. Os iões eram, então, desviados para um eléctrodo. Chadwick podia assim medir a corrente que passava no eléctrodo, com a qual podia contar os átomos e estimar a sua velocidade.
Chadwick utilizou alvos feitos de diferentes elementos, medindo a energia necessária à ejecção de electrões de cada alvo. Os raios gama não podiam explicar a velocidade dos átomos. A única boa explicação para o seu resultado... era uma partícula neutra.
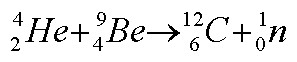
De forma a provar que a partícula era de facto o neutrão, Chadwick mediu a sua massa. Como não a podia medir directamente, mediu a massa de tudo o resto envolvido na colisão e usou esses dados no seu cálculo. Para a sua medida, Chadwick usou boro - 5B (que, tal como o berílio, emitia a radiação neutra). Bombardeou-o com raios a e colocou um alvo de hidrogénio no percurso dos raios neutros libertados pelo boro. Quando os raios atingiam o alvo, os protões eram libertados. Chadwick mediu assim a velocidade dos protões. Usando as leis de conservação do momento e energia, calculou a massa da partícula neutra. Ela tinha 1,0067 vezes a massa do protão.
A radiação neutra era realmente o tão procurado neutrão.